医療機器臨床試験の概要
中国臨床試験の要求
「医療機器監督管理条例」(国務院令650号)の規定に基づき、第1類医療機器は届出管理となり、臨床試験を実施する必要ないが、臨床評価資料を提出しなければならない。第2、3類医療機器の登録申請において、臨床試験を実施すべき。(臨床試験免除リストに納入された医療機器は除外)。臨床試験免除の医療機器も、申請する時に、臨床評価資料を提出すべき。
中国臨床試験施設(中国では臨床試験基地という)が少なく、臨床試験関連人員の経験不足、日本新GCPと中国GCPの相違等、中国において臨床試験実施する際、スムーズに進まないことがしばしばあります。
当社は中国臨床医及び日本臨床試験・薬事申請の経験者が常駐し、日中の医療ネットワークを活かし、高品質なサービスを提供し、臨床試験を受託いたします。
医療機器の分類確定は製品の予期用途、構造特徴及び使用方法を考慮しなければならない。医療機器分類規則、分類目録、標準により確定する。
![]()
サービス内容
・ 医療機器登録検査(型式試験)の実施をサポートします。
(製品技術要求の作成、関連資料の準備確認、サンプルの送付と回収、型式試験レポートの受領)
・ 臨床試験基地の選択及び連絡相談等に関するサービスを提供します。
・ 臨床試験実施計画書、同意説明書、CRFの作成及びサポートサービスを提供します。
・ 臨床試験申請、届出、不具合事象報告等のサービスを提供します。
・ 臨床試験のモニタリング、臨床試験報告書を取得する迄の全業務を提供します。
・ 臨床試験免除に関する確認及び提案、臨床試験免除の場合、臨床評価資料作成等のサービスを提供します。
![]()
医療機器臨床試験手順

中 国 臨 床 試 験 体 制
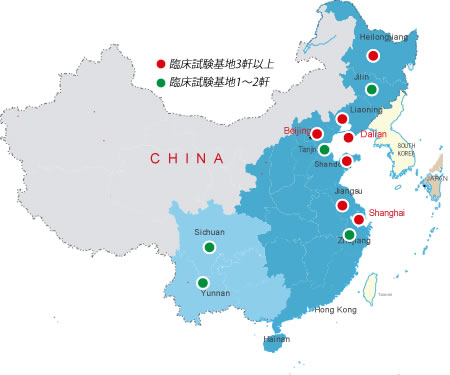
中国の規制によると、臨床試験はSFDA承認した医療機関(臨床試験基地)に実施しなければならない。
当社は中国臨床試験基地と提携し、低コスト、高品質、高効率に臨床試験受託サービスを提供します。
![]()
新橋科学のアドバンテージ
・臨床診療、臨床開発、薬事申請経験者は薬事臨床開発部を構成
・臨床試験、薬事申請を同時に受託可能、申請期間を短縮
・整形外科、循環器及び婦人科など多分野の臨床試験経験
・中国数多くの臨床試験基地と連携し、治験体制の構築
![]()
![]()